Den første representanten for alkener er etylen. Fysiske egenskaper, produksjon, anvendelse av etylen
En lys representant for umettede hydrokarboner -eten (etylen). Fysiske egenskaper: fargeløs brennbar gass, eksplosiv i en blanding med oksygen og luft. I betydelige mengder produseres etylen fra olje for den etterfølgende syntese av verdifulle organiske stoffer (monohydriske og divalente alkoholer, polymerer, eddiksyre og andre forbindelser).
Den homologe serien av etylen, sp2hybridisering

Hydrokarboner, lik i struktur og egenskaper med etenom, kalles alkener. Historisk sett ble et annet begrep for denne gruppen, olefiner, løst. Den generelle formel CnH2n gjenspeiler sammensetningen av hele klassen av stoffer. Den første representanten er etylen, i molekylet hvorav karbonatomer danner ikke tre, men bare to x-bindinger med hydrogen. Alkener - umettede eller umettede forbindelser, deres formel C2H4. Kun 2 p og 1 blandes i form og energis-elektronmoln av karbonatomet, dannes totalt tre x-bindinger. Denne tilstanden kalles sp2-hybridisering. Den fjerde valensen av karbon er bevart, i molekylet er det en π-binding. I strukturformelen reflekteres det strukturelle trekk. Men symboler for å betegne ulike typer kommunikasjon på kretser blir vanligvis brukt det samme - bindestreker eller prikker. Strukturen av etylen bestemmer dens aktive interaksjon med stoffer av forskjellige klasser. Tilsetningen av vann og andre partikler skyldes brudd på en svak π-binding. De frigjorte valensene er mettede på grunn av elektronene av oksygen, hydrogen, halogener.
Etylen: fysiske egenskaper av stoffet
Eten under normale forhold (normal atmosfærisktrykk og temperatur på 18 ° C) er en fargeløs gass. Den har en søt (eterisk) lukt, dens innånding utøver en narkotisk effekt på en person. Cures ved -169.5 ° C, smelter under de samme temperaturforholdene. Etanet kokes ved -103,8 ° C. Den antennes når den oppvarmes til 540 ° C. Gassen brenner godt, flammen lyser, med svak sot. Etylen oppløses i eter og aceton, mye mindre i vann og alkohol. Den avrundede molarmassen av stoffet er 28 g / mol. Den tredje og fjerde representanten for den homologe serien av eten er også gassformige stoffer. De fysiske egenskapene til femte og følgende alkener er forskjellige, de er væsker og faste stoffer.
Forberedelse og egenskaper av etylen
Tysk kjemiker Johann Becher ble ved et uhell bruktEtylalkohol i eksperimenter med konsentrert svovelsyre. Dette var første gang eten ble oppnådd i laboratorieforhold (1680). I midten av XIX århundre, A.M. Butlerov ga forbindelsen navnet etylen. Fysiske egenskaper og kjemiske reaksjoner har også blitt beskrevet av en berømt russisk kjemiker. Butlerov foreslo en strukturell formel som reflekterer stoffets struktur. Metoder for å oppnå det i laboratoriet:
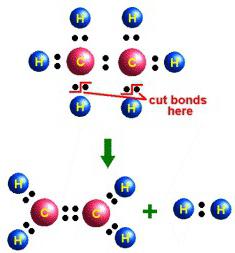
- Katalytisk hydrogenering av acetylen.
- Dehydrohalogenering av klorethan i reaksjon med en konsentrert alkoholholdig oppløsning av en sterk base (alkali) ved oppvarming.
- Spalting av vann fra molekyler av etylalkohol (dehydrering). Reaksjonen foregår i nærvær av svovelsyre. Dens ligning er: H2C-CH2-OH → H2C = CH2 + H20
Industriell produksjon:
- Oljeprosessering - sprekk og pyrolyse av hydrokarbonråmaterialer;
- dehydrogenering av etan i nærvær av en katalysator. H3C-CH3 → H2C = CH2 + H2
Strukturen av etylen forklarer dens typiske kjemiske reaksjoner - tilsetning av partikler med C-atomer, som er i en multiplebinding:
- Halogenering og hydrohalogenering. Produktene av disse reaksjonene er halogenerte derivater.
- Hydrogenering (metning med hydrogen), produksjon av etan.
- Oksidasjon til dihydrisk alkohol etylenglykol. Dens formel: OH-H2C-CH2-OH.
- Polymerisering i henhold til skjemaet: n (H2C = CH2) → n (-H2C-CH2-).


Anvendelser av etylen
Når fraksjonert destillasjon av olje i store mengderetylen er oppnådd. De fysiske egenskapene, strukturen, stoffets kjemiske natur gjør det mulig å bruke det i produksjon av etylalkohol, halogenerte derivater, alkoholer, oksyd, eddiksyre og andre forbindelser. Etylen er en polyetylenmonomer, så vel som utgangsforbindelsen for polystyren.
Dikloretan, som er oppnådd fra eten og klor,er et godt løsemiddel brukt i produksjon av PVC (PVC). Polyetylen med lavt og høyt trykk er laget av film, rør, tallerkener, polystyren-CD-tilfeller og andre detaljer. PVC er grunnlaget for linoleum, vanntette regnfrakker. I landbruket behandler etenom frukt før høsting for å akselerere modning.
</ p>







